| Rev Esp Endocrinol Pediatr 2013;4 Suppl(1):138-142 | Doi. 10.3266/RevEspEndocrinolPediatr.pre2013.Apr.179 |
| Diabetes |
| Sent for review: 11 Apr. 2013 | Accepted: 11 Apr. 2013 | Published: 2 May. 2013 |
| Congreso SEEP |
| Correspondence:Congreso SEEP E-mail: seep@seep.es |
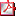 Tabla - O3/d2-017 Tabla - O3/d2-017 |
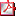 Tabla - O3/d3-020 Tabla - O3/d3-020 |
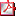 Tabla - O3/d3-021 Tabla - O3/d3-021 |
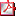 Tabla - O3/d3-022 Tabla - O3/d3-022 |
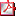 Tabla - O3/d3-023 Tabla - O3/d3-023 |
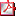 Figura - O3/d3-018 Figura - O3/d3-018 |
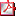 Figura - O3/d3-019 Figura - O3/d3-019 |
|
|
O3/d2-017 HIPERINSULINISMO CONGÉNITO COMO ENTIDAD HETEROGÉNEA. A PROPÓSITO DE 4 CASOS CLÍNICOS. L. Salamanca Fresno1, J. Guerrero Fernández1, A. Gómez Núñez2, J. Tovar Larrucea3, I. González Casado1, A. Campos Barros4. (1) Hospital Universitario La Paz / Servicio de Endocrinología Pediátrica, Madrid. (2) INGEMM (Instituto de Genética Médica y Molecular), IdiPAZ, UAM, Hosp. Univ. La Paz; Madrid. (3) Hospital Universitario La Paz / Servicio de Cirugía Pediátrica. Madrid. (4) INGEMM (Instituto de Genética Médica y Molecular), IdiPAZ, UAM, Hosp. Univ. La Paz y Centro de Investigación Biomédica en Enfermedades Raras (CIBERER, U753), Instituto Carlos III, Madrid. Introducción: El hiperinsulinismo congénito (HIC) constituye una patología altamente heterogénea desde un punto de vista clínico, genético e histológico. Mutaciones en los genes ABCC8 y KCNJ11, codificantes de las subunidades SUR1 y Kir6.2 del canal KATP, representan el defecto molecular predominante. Objetivos: Establecer una correlación fenotipo-genotipo en 4 pacientes diagnosticados de HIC en los últimos 12 meses en nuestro centro. Material/Métodos: La sospecha clínica se estableció en base a hipoglucemias hipocetósicas con insulina elevada, baja concentración de ácidos grasos libres, hiperrespuesta a glucagón y requerimientos elevados de glucosa. Estudios moleculares: Análisis mutacional de los genes ABCC8 y KCNJ11 mediante HRM, secuenciación de las variantes detectadas y análisis de deleciones/duplicaciones mediante MLPA. Análisis de LOH somática mediante genotipado de microsatélites en ADN extraído de muestra pancreática. Resultados: Las características más relevantes se resumen en tabla adjunta. El caso 1 presentó una forma focal clásica en cabeza pancreática sin respuesta a diazóxido, asociada a una mutación ya descrita en el alelo paterno y pérdida somática del alelo materno en el tejido afectado. El caso 2 con respuesta a diazóxido, presentó una nueva mutación en el exón 35 del alelo paterno que afecta a un residuo filogenéticamente muy conservado. El caso 3 mostró una forma con captación difusa en el PET con 18F-DOPA y respuesta parcial a diazóxido, asociada a una nueva mutación en el exón 25 del alelo materno que afecta igualmente a un residuo muy conservado. En el caso 4, forma difusa con respuesta parcial a diazóxido sin mutaciones en secuencias codificantes, se identificó una variante rara (FA: <0,1%) en el intrón 7 del alelo paterno de ABCC8 en heterozigosis que puede afectar el proceso de splicing. Se efectuó pancreatectomía cefálica con anastomosis en Y de Roux en los pacientes 1 y 4, resultando curativa en el HIC focal; el último precisó transitoriamente tratamiento médico intensivo postcirugía, suspendido recientemente con buen control glucémico. Conclusiones: Hemos identificado 3 mutaciones de ABCC8 en heterozigosis (2 no descritas previamente) en pacientes con HIC de presentación clínica heterogénea y respuesta variable a diazóxido, confirmando la variabilidad fenotípica asociada a mutaciones dominantes de este gen.
O3/d3-018
EL PAPEL DE LA GRELINA COMO INHIBIDOR DEL EFECTO DE LAS CITOQUINAS EN UNA LÍNEA DE CÉLULAS BETA PANCREÁTICAS HUMANAS. A. Díaz Gañete, F. Manuel Visiedo García, M. Mata Pica, F. Manuel Medina Prieto, C. Segundo Iglesias, A. Lechuga Sancho. Unidad de Investigación, Hospital Universitario Puerta del Mar, Cádiz. La línea celular 1.1E7 procede de la electrofusión de un cultivo primario de islotes pancreáticos humanos con PANC-1, línea celular humana de un carcinoma ductal pancreático. La grelina es una hormona peptídica que afecta al desarrollo, proliferación, y supervivencia de la célula beta pancreática. En la DM1 es hay una infiltración inflamatoria del islote pancreático que induce la muerte de las células beta. Nuestra hipótesis es que el tratamiento con grelina protege a esta línea celular de la acción deletérea de las citokinas. Métodos: Mantuvimos cuatro condiciones de cultivo: control (RPMI 1640, con 10% FBS, Penicilina/Estreptomicina 100 ug/ml, Piruvato Sódico 11,004 mg/L, Hepes 1M en 0,85% NaCl, 2-Mercaptoetanol y D-Glucosa 5 mM), CTKs (IFN-γ 100 ng/ml + IL1-β 0,05 ng/ml + TNF-α 50 ng/ml), grelina (100 nM) y mezcla de citoquinas con grelina. Cada experimento se repitió al menos 4 veces (n=4). La proliferación se midió mediante imnunohistoquímica para Ki67. La apoptosis se analizó mediante TUNEL. La activación de caspasas se midió mediante western-blot para caspasa 8 y 9), y la funcionalidad se midió con sobrecarga de glucosa, determinando la insulina mediante ELISA. Resultados: La grelina revierte los efectos deletéreos de las citoquinas en un 80% en cuanto a supervivencia. La incubación con grelina disminuye la expresión de las proteínas proapoptóticas caspasa 9 y Bcl-2 en un 60%, y la de Bid en un 50%. No observamos diferencias en la cuantificación de caspasa 8. En la sobrecarga de glucosa, la incubación con grelina, recupera un 70% de la secreción de insulina que se inhibe con citoquinas. Conclusiones: Las citoquinas inducen apoptosis de las 1.1E7, y disminuyen su capacidad proliferativa. La grelina disminuye la apoptosis inducida por citoquinas y revierte parcialmente la disminución de la proliferación que éstas inducen. Este efecto protector parece ejercerse principalmente a nivel de la vía intrínseca. La grelina recupera parcialmente la secreción de insulina de esta línea celular sometida a ambiente inflamatorio.
O3/d3-019
EL PAPEL DE LA GRELINA COMO PROTECTOR DEL EFECTO DE LAS CITOQUINAS EN LA LÍNEA CELULAR INS-1E. A. Díaz Gañete, F. M. Visiedo García, I. María Lomas Romero, F. M. Medina Prieto, C. Segundo Iglesias, A. Lechuga Sancho. Unidad de Investigación, Hospital Universitario Puerta del Mar, Cádiz. INS-1E es una línea celular procedente de tumores inducidos en rata. La grelina, es una hormona peptídica que afecta al desarrollo, proliferación, y supervivencia de la célula beta pancreática. En la DM1 es hay una infiltración inflamatoria del islote pancreático que induce la muerte de las células beta. Nuestra hipótesis es que el tratamiento con grelina protege a esta línea celular de la acción deletérea de las citoquinas. Métodos: Mantuvimos cuatro condiciones de cultivo: control (RPMI 1640, con 10% FBS, Penicilina/Estreptomicina 100 ug/ml, Piruvato Sódico 11,004 mg/L, Hepes 1M en 0,85% NaCl, 2-Mercaptoetanol y D-Glucosa 11 mM), CTKs (IFN-γ 100 ng/ml + IL1-β 0,05 ng/ml + TNF-α 50 ng/ml), grelina (100 nM) y mezcla de citoquinas con grelina. Cada experimento se repitió al menos 4 veces (n=4). La proliferación se midió mediante imnunohistoquímica para BrdU y Ki67. La apoptosis se analizó mediante TUNEL y citometría de flujo para caspasa 3 activada. La activación de caspasas se midió mediante western-blot, y la funcionalidad se midió con sobrecarga de glucosa, determinando la insulina mediante ELISA. Resultados: La grelina revierte los efectos deletéreos de las citoquinas en un 80% en cuanto a supervivencia y proliferación. La incubación con grelina disminuye la expresión de las proteínas proapoptóticas caspasa 8 y Bax en un 50% con respecto a las CTKs, la de Bcl-2 en un 40%, y aumenta un 50 % la expresión de Erk, que es indicador de protección frente a la apoptosis. No observamos diferencias en la cuantificación de caspasa 9 ni Bcl-xl. En la sobrecarga de glucosa, la incubación con grelina, recupera un 80% de la secreción de insulina que se inhibe con citoquinas. Conclusiones: Las citoquinas inducen apoptosis de las INS-1E, y disminuyen su capacidad proliferativa. La grelina disminuye la apoptosis inducida por citoquinas y revierte parcialmente la disminución de la proliferación que éstas inducen. Este efecto protector parece ejercerse sobretodo a nivel de la vía extrínseca, si bien no podemos descartar un cierto efecto por la vía intrínseca. La grelina recupera parcialmente la secreción de insulina de esta línea celular sometida a ambiente inflamatorio.
O3/d3-020
EPIDEMIOLOGÍA DE LA DIABETES MELLITUS DE TIPO 1 EN MENORES DE 15 AÑOS EN ESPAÑA. S. Conde Barreiro1, M. Rodríguez Rigual2, G. bueno Lozano3, J. P. López Siguero4, B. González Pelegrín5, M. Pilar Rodrigo Val6. (1) Centro de Salud de Barbastro (Huesca)/ Pediatría, Barbastro/Huesca. (2) Hospital Universitario Miguel Servet. Zaragoza. (3) Hospital Clínico Lozano Blesa. Zaragoza. (4) Hospital Materno Infantil Carlos Haya. Málaga. (5) Hospital de Barbastro. Huesca. (6) Departamento de Salud Pública del Servicio Aragonés de Salud. Objetivos: Revisar los estudios epidemiológicos sobre la diabetes Mellitus Tipo 1 (DM1) en menores de 15 años realizados en España para mejorar el conocimiento de la incidencia de la enfermedad y su evolución. Material y métodos: Revisión bibliográfica de las publicaciones y comunicaciones sobre epidemiología de la DM1 en menores de 15 años en España y sus diferentes comunidades autónomas, utilizando como fuentes: 1) búsqueda en internet (a través de Pubmed y Google Académico); 2) revisión de los libros de abstracts de los congresos nacionales de la Sociedad Española de Endocrinología Pediátrica (SEEP) y de la Sociedad Española de Diabetes (SED) entre los años 2001 y 2012; 3) revisión de las citas bibliográficas referidas en los artículos encontrados. Resultados: Se han encontrado estudios de todas las comunidades autónomas excepto Baleares y La Rioja. La metodología de los estudios es heterogénea, encontrando diferencias en cuanto al ámbito de estudio, límite de edad y método de recogida de datos. Los periodos de estudio varían entre 12 meses y 20 años. Las tasas de incidencia comunicadas varían desde los 11,5 casos/100.000 habitantes-año (c/105h-a) en Asturias hasta los 27,6 c/105h-a de Castilla La Mancha, siendo por ello regiones de incidencia alta a muy alta según la clasificación de la Organización Mundial de la Salud. En algunas Comunidades Autónomas no se ha observado un incremento significativo de la incidencia de DM1 a lo largo de los últimos 20 años. Sin embargo, otros estudios encuentran un incremento de la incidencia, especialmente marcado en los últimos 5-10 años. Los datos de prevalencia comunicados varían desde 0,95 hasta 1,53 casos/1000 habitantes. En ocasiones se especifica el porcentaje de casos que presentan CAD al diagnóstico, habitualmente en el rango del 25-40%. Conclusiones: En España se han realizado múltiples estudios epidemiológicos de DM1 en menores de 15 años, con una metodología heterogénea. Creemos conveniente mantener los registros de DM1 en funcionamiento y crearlos donde no existen, así como unificar la metodología utilizada de cara a obtener datos precisos sobre la epidemiología de la DM1 en España y conocer la evolución de la incidencia de la enfermedad en los próximos años.
O3/d3-021
EVOLUCIÓN DE LA FUNCIÓN PANCREÁTICA EN EL TRASPLANTE HEPATOPANCREÁTICO EN PACIENTES CON DIABETES SECUNDARIA. A.C. Barreda Bonis1, J. Guerrero-Fernández2, J. Sarriá2, J.A.Tovar Larrucea2, P. Jara2, I. González-Casado2. (1) Hospital Infantil La Paz/Servicio de Endocrinología Infantil, Madrid. (2) H. Infantil La Paz, Madrid. Introducción: Son escasos los estudios que reflejan la evolución del trasplante pancreático en la infancia. El trasplante no sólo supone una mejoría en la calidad de vida de los pacientes con diabetes al suprimir la terapia insulínica, sino que además evita el desarrollo de diabetes secundaria a inmunosupresión y su repercusión en el caso del trasplante multivisceral. Objetivos: Presentar la evolución de tres casos de trasplante pancreático, en dos pacientes asociados a trasplante hepático y uno de ellos en el seno de un trasplante multivisceral. Resultados: En la tabla se recogen los marcadores de función pancreática endocrina pre y postrasplante. En el caso de los pacientes afectos con fibrosis quística la presencia de cirrosis hepática marcó la indicación de trasplante hepato-pancreático. La indicación de trasplante multivisceral (hígado, intestino y páncreas) en el caso del S. Martínez-Frías (diabetes neonatal por agenesia pancreática asociada a atresia duodenal, de vía biliar y malrotación intestinal) fue debida a fracaso intestinal con fallo de medro, diarrea rebelde y hepatopatía, siendo el único caso trasplantado superviviente en la actualidad. Todos los casos presentaban insuficiencia pancreática exocrina y endocrina insulindependiente, resueltos postrasplante. En un solo caso se ha precisado la necesidad de insulinoterapia posteriormente en el contexto de una enfermedad injerto contra huésped. Discusión: Pese a los escasos datos publicados, el trasplante pancreático de diabetes secundarias asociado a otros injertos, no sólo proporciona suficiencia pancreática de una manera más fisiológica, sino que además favorece la inmunotolerancia y preserva la funcionalidad del injerto asociado, que de otra manera se vería dañado por la hiperglucemia, a su vez agravada por la inmunosupresión. Otras ventajas serían la facilidad de la técnica quirúrgica y la mejoría en la calidad de vida de estos pacientes. Son necesarios estudios posteriores para ver la evolución a largo plazo.
O3/d3-022
ANTI-ZNT8A UN NUEVO MARCADOR PARA EL DIAGNÓSTICO DE LA DIABETES MELLITUS TIPO 1. A. Aguayo1, I. Urrutia1, I. Rica1, R. Bilbao1, M. Rodríguez Rigual2, L. Castaño1, C. Luzuriaga3, M. Oyarzabal4, M. Caimari5, A. Gómez Gila6, A. Vela1, M.Clemente7, R. Barrio Castellano8, B. García Cuartero9, J. Núñez Rodriguez10. (1) Hospital de Cruces, CIBERDEM, Barakaldo/Bizkaia. (2) Hospital Miguel Servet, Zaragoza. (3) H. Marqués de Valdecillas. Santander. (4) H. Virgen del Camino. Pamplona. (5) H. Son Espases. Mallorca. (6) H. Virgen del Rocío. Sevilla. (7) H. Vall d´Hebron. Barcelona. (8) H. Ramón y Cajal. Madrid. (9) H. Severo Ochoa. Leganés. (10) H. de Basurto. Bilbao. La autoinmunidad frente a la célula beta pancreática es característica de la DM1 y diversos autoanticuerpos se utilizan como marcadores para el diagnóstico: IAA (anti-insulina), GAD (anti-descarboxilasa del ácido glutámico) e IA-2 (anti-tirosina fosfatasa IA2). El transportador de Zn 8 (ZnT8), ha sido identificado recientemente como uno de los blancos de la autoinmunidad en este tipo de diabetes. Objetivo: Valorar el papel del anticuerpo anti-ZnT8A en el diagnóstico de la DM1. Métodos: Los anti-IAA, anti-GAD, anti-IA2 y anti-ZnT8A se han determinado por radioinmunoensayo con antígeno recombinante. Los valores de normalidad se han establecido tomando como punto de corte la media ± 3SD del valor obtenido en 100 niños sanos (<40 IAA, <0.02 GAD e IA2, <0.001 ZnT8A) y los ensayos han sido validados en diferentes workshop de la IDS. Se han analizado en 107 niños al inicio clínico de la diabetes con una edad al debut de 8,9 ± 4,2 años y en 100 niños sanos. Se define sensibilidad como el porcentaje de diabéticos que tienen anticuerpos positivos y especificidad como la proporción de sujetos normales que los tienen negativos. Resultados: El 90,6% de los pacientes tiene de uno a tres de los anticuerpos GAD, IAA y IA2 positivos y sólo el 9,4% es negativo para los 3 anticuerpos. En este último grupo encontramos un caso con anti-ZnT8A positivo (10%). La especificidad del método para cada anticuerpo es > 97.5 % (workshop IASP2012) y la sensibilidad se describe en la tabla 1. Los anti-ZnT8A positivos son mas frecuentes en niños mayores de 8 años [(78% vs. 22%) (p<0.001)], y los anti-IAA positivos en niños menores de 8 años [(55.7% vs. 44.3%) (p<0.001)]. No se encuentran diferencias con respecto al sexo. Conclusiones: 1. Los anti-ZnT8A están presentes en una proporción significativa de pacientes pediátricos al debut y su frecuencia aumenta con la edad. 2. La determinación de anti-ZnT8A aumenta la sensibilidad para el diagnóstico de DM1.
O3/d3-023
CUMPLIMIENTO EN POBLACIÓN PEDIÁTRICA CON DIABETES TIPO 1 DE OBJETIVOS DE CONTROL METABÓLICO SEGÚN LA ASOCIACIÓN AMERICANA DIABETES Y LA SOCIEDAD INTERNACIONAL DE DIABETES PEDIÁTRICA. P. Enes1, M. Martín-Frías2, R. Yelmo2, M. Á. Álvarez2, M. Alonso2, R. Barrio2. (1) Hospital Ramón y Cajal/Unidad de Endocrinología y Diabetes Pediátrica. Servicio de Pediatría. Madrid. (2) Hospital Ramón y Cajal. Madrid. Introducción: El estudio del “T1D Exchange Clinic Registry” de EEUU realizado en 13.316 pacientes pediátricos con diabetes tipo 1 (DM1) (2013) revela un pobre cumplimiento de los objetivos de HbA1c establecidos por la American Diabetes Association (ADA) y la International Society for Pediatric and Adolescent Diabetes (ISPAD). Objetivo: Evaluar qué proporción de nuestros pacientes pediátricos con DM1 cumplen los objetivos de HbA1c, tensión arterial (TA), lípidos e IMC propuestos por la ADA y la ISPAD. Pacientes y métodos: Estudio transversal de 247 niños y adolescentes con DM1 atendidos en nuestra Unidad de Diabetes. Analizamos: cumplimiento de objetivos propuestos por la ADA (HbA1c: <6 años: <8,5%; 6-12 años: <8% y 13-19 años: <7,5%; LDLc <100 mg/dl; TA. Resultados: Edad media de los pacientes 12,6±4,6 años, al diagnóstico 6,1±4,3 años, 47% mujeres, tiempo de evolución 6,4±4,3 años y HbA1c media global 6.9±0.69%. Consiguieron los objetivos de HbA1c ADA/ISPAD el 100/100% de los <6 a, 100/91% entre 6-12 años y 88/85% de 13-18 años. Conclusiones: El grado de cumplimiento de los objetivos de buen control metabólico de la ADA e ISPAD es muy bueno en nuestra población de niños y adolescentes con DM1, tanto en los tratados con ISCI como con MDI. |
| References |