| Rev Esp Endocrinol Pediatr 2018;9(3):31-36 | Doi. 10.3266/RevEspEndocrinolPediatr.pre2018.Oct.485 | |||||||||
| Síndrome de Prader Willi | |||||||||
| Prader-Willi Syndrome | |||||||||
| Sent for review: 11 Oct. 2018 | Accepted: 11 Oct. 2018 | Published: 4 Feb. 2019 | |||||||||
| Marta Ramon-Krauel | |||||||||
| Servicio de Endocrinología Pediátrica. Hospital Sant Joan de Déu. Barcelona | |||||||||
| Correspondence:Marta Ramon-Krauel, Servicio de Endocrinología Pediátrica, Hospital Sant Joan de Déu, Passeig Sant Joan de Déu, 2, 08950, Barcelona E-mail: mramonk@sjdhospitalbarcelona.org | |||||||||
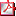 Tabla 1 - Características que nos deben conducir a realizar estudio genético Tabla 1 - Características que nos deben conducir a realizar estudio genético | |||||||||
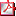 Tabla 2 - Esquema de visitas recomendado Tabla 2 - Esquema de visitas recomendado | |||||||||
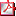 Figura 1 - Genética del síndrome de Prader Willi Figura 1 - Genética del síndrome de Prader Willi | |||||||||
 Figura 1 - Genética del síndrome de Prader Willi Figura 1 - Genética del síndrome de Prader Willi | |||||||||
| |||||||||
1. Introducción El síndrome de Prader Willi (SPW) es una enfermedad genética con discapacidad intelectual, multisistémica y compleja. Está causada por la pérdida o inactivación de genes paternos en la región q11-q13 del cromosoma 15 (1,2). Su incidencia es de 1:15.000 a 1:25.000 recién nacidos (3). El SPW presenta unas manifestaciones características, pero existe mucha variabilidad de presentación en cada persona afecta. Durante los primeros meses de vida es habitual que presenten dificultades en la succión, hipotonía, excesivo letargo y fallo de medro. Posteriormente aparecen otras manifestaciones como son retraso del desarrollo, dificultades de aprendizaje y trastornos de conducta como rabietas y actitudes obsesivas y poca tolerancia a la frustración. Se asocia a una hiperfagia marcada y ausencia de control en la ingesta acompañado de otros trastornos endocrinos, lo que conduce a una obesidad importante con complicaciones que conllevan a un empeoramiento de la calidad de vida y aumento de la mortalidad (4,5).
2. Diagnóstico El diagnóstico temprano es clave ya que el manejo precoz por un equipo mutlidisciplinar altamente especializado mejora su pronóstico(2). El conocimiento de las características clínicas de estos pacientes ya en edades tempranas por parte de los pediatras es fundamental y, gracias a esto, a lo largo de los años se ha ido logrando un diagnóstico cada vez más precoz. La tabla 1 muestra las características principales de cada edad que nos deben hacer sospechar el diagnóstico. Ante la sospecha clínica debemos proceder al estudio genético. Como hemos mencionado anteriormente el SPW se produce por una falta de expresión de genes paternos en la región 15q11-q13. Los genes de estas regiones están fisiológicamente regulados por impronta con el alelo materno silenciado. Si el alelo paterno está ausente, defectuoso o silenciado se produce el SPW. Con un análisis del estado de metilación del ADN en las regiones críticas de Prader Willi se llega al diagnóstico en más del 99% de los casos. Sin embargo se requiere de más estudios para la tipificación del subtipo. En la mayoría de los casos el SPW está causado por deleción paterna (70-75%) o por disomía uniparental materna (DUPm) (20-25%). Los defectos de impronta o traslocaciones son infrecuentes (Figura 1).
3. Características clínicas del SPW En el SPW existe una disfunción hipotalámica que explica gran parte de los síntomas incluyendo la hiperfagia severa, la dificultad en la regulación térmica, el alto umbral para el dolor, las apneas centrales del sueño, los déficits hormonales como el déficit de hormona de crecimiento (GH) y gonadotropinas, la talla baja, la alteración de la composición corporal con mayor masa grasa y menor masa magra, y los trastornos cognitivos y del comportamiento. Alteraciones endocrinas: - Déficit de hormona de crecimiento Se estima que el 80% de los niños tienen un déficit de GH y éste persiste en la edad adulta en más del 30% de los casos(6). El déficit de GH conlleva a una talla baja y además, igual que ocurre en los niños con déficit de GH, hay un cambio en la composición corporal con mayor masa grasa y menor masa magra(7). Sin embargo los estudios demuestran que los beneficios en talla y composición corporal son iguales en todos los pacientes con SPW independientemente de que se demuestre o no un déficit en los test de estímulo(7). - Hipogonadismo En el SPW se produce un hipogonadismo con un componente central pero también se produce una disfunción gonadal primaria(8). En niños en el 80-90% de los casos se manifiesta ya en la infancia por criptorquidia uni o bilateral, hipoplasia escrotal y en ocasiones asocia micropene. En las niñas la hipoplasia genital pasa más desapercibida. En la pubertad en la mayoría de varones y en muchas mujeres es frecuente la falta de desarrollo puberal o que se produzca un desarrollo puberal incompleto y en las mujeres suele haber amenorrea. Siempre que exista fallo gonadal debe hacerse tratamiento hormonal sustitutivo, lo que aplica a la mayoría de varones y en mujeres se aboga por individualizar la terapia siguiendo los niveles de inhibina B en plasma(9). La fertilidad suele estar afectada pero debe considerarse medidas anticonceptivas en el caso de las mujeres en que la fertilidad pudiera estar conservada(9). Aunque lo más frecuente es la pubertad retrasada o fallo gonadal en algunos casos se produce una pubertad adelantada. - Hipotiroidismo La frecuencia en la que ocurre el hipotiroidismo varía según las series pero en niños está descrito hasta un 20-30% de los casos. La mayoría son hipotiroidismos centrales aunque también hay casos de hipotiroidismos primarios. Se recomienda realizar un despistaje anual. - Insuficiencia adrenal Existe un aumento de la mortalidad temprana y se estima un 3% de mortalidad antes de los 30 años. Se cree que algunas de estas muertes súbitas podrían ser producidas por una insuficiencia adrenal(10). Teóricamente los niños con SPW podrían tener una insuficiencia adrenal central por su disregulación hipotalámica. No existen recomendaciones claras de cómo y cuándo hacer despistaje pero las guías recomiendan suplementar con corticoides en caso de enfermedad importante o cirugía. Además suelen desarrollar una pubarquia precoz o adelantada aunque se desconoce el mecanismo. - Obesidad y complicaciones asociadas En los niños con SPW existen muchos factores que favorecen la adiposidad: 1) presentan ya al nacimiento una menor masa magra y mayor masa grasa, 2) las alteraciones en la regulación del apetito, 3) tienen un gasto calórico 30% inferior a niños de su misma edad 4) los déficits hormonales, especialmente el déficit de GH, 5) la hipotonía y la falta de masa muscular que dificulta la realización de ejercicio. La obesidad y la distribución de esta grasa corporal de forma anómala conllevan a complicaciones metabólicas. Aproximadamente el 25% de los pacientes con SPW desarrollan diabetes tipo 2 y la media de aparición es alrededor de los 20 años de edad. Por todo ello una dieta saludable hipocalórica con supervisión y restricción del acceso a alimentos y el aumento de la actividad física deben ser el pilar del tratamiento ya desde el primer año de vida, una vez resuelta la fase inicial de fallo de medro, con el objetivo de prevenir el desarrollo de la obesidad. - Alteraciones en la mineralización ósea La densidad mineral ósea disminuida y un alto riesgo de osteoporosis y fracturas. Es importante controlar los factores de riesgo sobre los que podemos actuar como reponer los déficits hormonales, recomendar actividad física y mantener unos niveles adecuados de vitamina D y una ingesta apropiada de calcio. El tratamiento con hormona de crecimiento también ha demostrado mejorías en la densidad mineral ósea (6) Alteraciones clínicas no endocrinológicas: Dado que el pediatra endocrinólogo suele ser el actor principal en el manejo de estos niños debemos conocer también el resto de manifestaciones clínicas. - Hipotonía y retaso psicomotor Todos los pacientes presentan hipotonía y disminución de la masa muscular y es especialmente marcada en los primeros meses de vida por lo que la estimulación precoz es imprescindible para mejorar su tono muscular. - Dificultades en la alimentación La mayoría de los casos al nacer presentan dificultades en la alimentación que pueden llegar a precisar alimentación por sonda nasogástrica para evitar el fallo de medro. Esto se debe a una pobre succión por falta de tono muscular de los músculos de la boca que posteriormente conlleva también a dificultades en el lenguaje. Es por ello que deben ser referidos a una nutricionista y a una logopeda especializada lo antes posible. - Apneas del sueño Presentan apneas del sueño central además de apneas obstructivas. Es imprescindible realizar una polisomnografía (PSG) antes y después de iniciar tratamiento con GH. Deben ser valorados por un otorrinolaringólogo y en caso de ser necesario debe procederse a una amigdalectomia/adenoidectomía. En caso de persistencia de las apneas deben ser referidos a un neumólogo con experiencia ya que pueden precisar soporte ventilatorio nocturno. - Escoliosis y otros problema ortopédicos Con frecuencia presentan escoliosis y pies planos por lo que deben ser evaluados anualmente por un traumatólogo/ortopeda infantil. - Coeficiente intelectual, trastornos de la conducta y trastornos psiquiátricos El coeficiente intelectual varía entre 50 y 85%. Estudios recientes muestran que el tratamiento con hormona de crecimiento mejora el coeficiente intelectual a largo plazo(11). En el primer año de vida los niños con SPW son muy sociables. Posteriormente aparecen alteraciones en el comportamiento como rabietas, actitudes obsesivo-compulsivas, cambios de humor, rascado agresivo de la piel (10). En algunos casos durante la adolescencia desarrollan trastornos psiquiátricos de tipo psicótico o afectivo. Es imprescindible el seguimiento por neurología y un equipo de salud mental, además del soporte del médico y el entorno del paciente.
4. Abordaje clínico y tratamiento Dado que el SPW es una enfermedad rara y requiere de un equipo multidisciplinar experto y altamente especializado, se recomienda que el seguimiento (Tabla 2) de estos pacientes sea en un centro que disponga de un equipo multidisciplinar con experiencia en su manejo. El tratamiento con hormona de crecimiento, la estimulación precoz y las pautas de alimentación y ejercicio iniciados de forma temprana han cambiado el curso clínico de esta enfermedad(12). El tratamiento con hormona de crecimiento debe iniciarse lo antes posible y los estudios demuestran el beneficio de iniciar antes de los dos años de edad, momento en que puede iniciarse la obesidad (11,13). Antes del inicio del tratamiento debe hacerse una valoración clínica minuciosa, una analítica completa, una edad ósea y una PSG además de una valoración por el otorrinolaringólogo. Como hemos mencionado anteriormente no precisamos de un test de estimulación de GH. El tratamiento con GH a largo plazo ha demostrado aportar beneficios y ser una terapia segura en pacientes con Prader Willi. En particular se ha demostrado un efecto positivo de esta terapia en composición corporal, crecimiento, fuerza muscular y tolerancia al ejercicio y capacidad cognitiva (11–17). El tratamiento con GH en niños con SPW es seguro siempre que hagamos una estrecha monitorización(12). En particular seguimiento clínico y PSG por la posibilidad de apneas y tratamiento oportuno en caso de ser necesario. Debemos monitorizar los niveles de glucosa, insulina y HbA1C. La escoliosis no suele ser contraindicación de tratamiento pero debemos hacer un seguimiento por el equipo de traumatología-ortopedia. La dosis recomendada es de 0,035 mg/kg/día pero en el caso de obesidad deberá ajustarse por la superficie corporal (1 mg/m2/día). En caso de niños menores a 2 años iniciamos con dosis más bajas y aumentamos a dosis completa en 3-6 meses. Los estudios muestran que la mejoría de la composición corporal se mantiene en la vida adulta si continuamos con el tratamiento con GH y que en cambio, hay un claro deterioro si se suspende(19). Sin embargo la mayoría de pacientes adultos con SPW no cumplen los criterios de tratamiento con GH, como ocurre en el caso de España. Debemos tener en cuenta que el tratamiento con GH está contraindicado si: IMC >+3DE, diabetes mellitus mal controlada, apneas severas mal controladas, si tienen un cáncer activo o una psicosis activa. | |||||||||
| References | |||||||||
1. Cassidy SB, Schwartz S, Miller JL, Al E. Prader-Willi syndrome. Genet Med. 2012;14(1):10-26.[Pubmed] 2. Goldstone AP, Holland AJ, Hauffa BP, Hokken-Koelega AC, Tauber M. Recommendations for the Diagnosis and Management of Prader-Willi Syndrome. J Clin Endocrinol Metab. 2008;93(11):4183-97.[Pubmed] 3. Cassidy SB. Prader-Willi syndrome. J Med Genet. 1997;34:917-23.[Pubmed] 4. Burman PIA, Ritze EM, Lindgren ANNC. Endocrine Dysfunction in Prader-Willi Syndrome?: A Review with Special Reference to GH. 2001;22(6):787-99.[Pubmed] 5. Emerick JE, Vogt KS. Endocrine manifestations and management of Prader-Willi syndrome. Int J Pediatr Endocrinol. 2013;2013(1):14. doi: 10.1186/1687-9856-2013-14. 6. Diene G, Mimoun E, Feigerlova E, Caula S, Molinas C, Grandjean H, et al. Endocrine Disorders in Children with Prader-Willi Syndrome - Data from 142 Children of the French Database. Horm Res Paediatr. 2010;74(2):121-8.[Pubmed] 7. Bekx MT, Carrel AL, Shriver TC, Li Z, Allen DB. Decreased energy expenditure is caused by abnormal body composition in infants with Prader-Willi Syndrome. J Pediatr. 2003;143(3):372-6.[Pubmed] 8. Hirsch HJ, Eldar-Geva T, Benarroch F, Rubinstein O, Gross-Tsur V. Primary testicular dysfunction is a major contributor to abnormal pubertal development in males with Prader-Willi syndrome. J Clin Endocrinol Metab. 2009;94(7):2262-8.[Pubmed] 9. Hirsch HJ, Eldar-Geva T, Bennaroch F, Pollak Y, Gross-Tsur V. Sexual dichotomy of gonadal function in Prader-Willi syndrome from early infancy through the fourth decade. Hum Reprod. 2015;30(11):2587-96.[Pubmed] 10. Whittington JE, Holland AJ, Webb T, Butler J, Clarke D, Boer H. Population prevalence and estimated birth incidence and mortality rate for people with Prader-Willi syndrome in one UK Health Region. J Med Genet. 2001;38(11):792-8. 11. Dykens EM, Roof E, Hunt-Hawkins H. Cognitive and adaptive advantages of growth hormone treatment in children with Prader-Willi syndrome. J Child Psychol Psychiatry. 2017;58(1):64-74.[Pubmed] 12. Bakker NE, Kuppens RJ, Siemensma EPC, Tummers-de Lind van Wijngaarden RFA, Festen DAM, Bindels-de Heus GCB, et al. Eight Years of Growth Hormone Treatment in Children With Prader-Willi Syndrome: Maintaining the Positive Effects. J Clin Endocrinol Metab. 2013;98(10):4013-22.[Pubmed] 13. Coupaye M, Lorenzini F, Lloret-Linares C, et. al. Growth Hormone Therapy for Children and Adolescents with Prader-Willi Syndrome Is Associated with Improved Body Composition and Metabolic Status in Adulthood. J Clin Endocrinol Metab. 2013;98(2):E328-35.[Pubmed] 14. Lindgren AC, Lindberg A. Growth Hormone Treatment Completely Normalizes Adult Height and Improves Body Composition in Prader-Willi Syndrome: Experience from KIGS (Pfizer International Growth Database). Horm Res. 2008;70(3):182-7.[Pubmed] 15. Carrel AL, Myers SE, Whitman BY, Eickhoff J, Allen DB. Long-term growth hormone therapy changes the natural history of body composition and motor function in children with prader-willi syndrome. J Clin Endocrinol Metab. 2010;95(3):1131-6.[Pubmed] 16. Bakker NE, Kuppens RJ, Siemensma EPC, Tummers-de Lind van Wijngaarden RFA, Festen DAM, Bindels-de Heus GCB, et al. Bone Mineral Density in Children and Adolescents With Prader-Willi Syndrome: A Longitudinal Study During Puberty and 9 Years of Growth Hormone Treatment. J Clin Endocrinol Metab. 2015;100(4):1609-18.[Pubmed] 17. Carrel AL, Myers SE, Whitman BY, Eickhoff J, Allen DB. Long-term growth hormone therapy changes the natural history of body composition and motor function in children with prader-willi syndrome. J Clin Endocrinol Metab [Internet]. 2010 Mar [cited 2018 Oct 2];95(3):1131-6. Available from: http://www.ncbi.nlm.nih.gov/pubmed/20061431 18. Deal CL, Tony M, Höybye C, Allen DB, Tauber M, Christiansen JS. Growth Hormone Research Society workshop summary: consensus guidelines for recombinant human growth hormone therapy in Prader-Willi syndrome. J Clin Endocrinol Metab. 2013;98(6):E1072-87.[Pubmed] 19. Kuppens RJ, Bakker NE, Siemensma EPC, et al. Beneficial Effects of GH in Young Adults With Prader-Willi Syndrome: A 2-Year Crossover Trial. J Clin Endocrinol Metab. 2016;101(11):4110-6. [Pubmed] | |||||||||