| Rev Esp Endocrinol Pediatr 2011;2 Suppl(1):121-132 | Doi. 10.3266/RevEspEndocrinologPediatr.pre2011.May.57 |
| Gónadas |
| Sent for review: 2 May. 2011 | Accepted: 3 May. 2011 | Published: 3 May. 2011 |
| Congreso SEEP |
| Correspondence: Congreso SEEP E-mail: seep@seep |
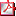 Tabla - P1D2-3-055_012_Patología ovárica infrecuente Tabla - P1D2-3-055_012_Patología ovárica infrecuente |
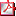 Tabla - P1d2-3-068_012_ADS Ovotesticular final Tabla - P1d2-3-068_012_ADS Ovotesticular final |
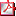 Tabla - P1d2-3-069_012_PPniñas Tabla - P1d2-3-069_012_PPniñas |
|
|
P1/d2-3-052 ANOMALÍA DE LA DIFERENCIACIÓN SEXUAL OVOTESTICULAR. A PROPÓSITO DE UN CASO CON MOSAICISMO 45X0-46 XY-46 XY ISODICÉNTRICO. M. De Toro Codes(1), I. Leiva Gea (2); G. Martínez Moya(1); MJ. Martínez-Aedo Ollero(3); JP. López Siguero (3); J. De la Cruz Moreno (1).
(1) Complejo Hospitalario de Jaén. (2) Hospital Costa del Sol, Marbella. (3) Hospital Carlos Haya, Málaga.
Introducción: Una de las alteraciones estructurales más frecuentes del cromosoma Y es el cromosoma Y isodicéntrico (idic). Es un cromosoma inestable que suele asociarse con una línea celular 45X0. En estos pacientes se han descrito diferentes fenotipos (fenotipo Turner, ambigüedad genital, varones fenotípicamente normales con azoospermia y/o talla baja) no relacionándose con la frecuencia de cada línea celular en linfocitos de sangre periférica.
Material y Métodos: Presentación de un caso clínico de anomalía de la diferenciación sexual en paciente con mosaicismo 45X0, 46XY, 46 XY isodicéntrico.
Caso clínico: Neonato trasladado desde hospital comarcal por ambigüedad genital. Antecedentes perinatales: embarazo controlado, oligoamnios desde la semana 38. Cesárea a las 40 semanas de gestación por SPBF. Apgar 9-10, reanimación tipo 1. Exploración: Peso: 2.330 gr. LRN: 45 cm. PC: 31 cm. Hipospadias con uretra en unión peneano-escrotal, aspecto de labios mayores fusionados englobando pene. No se palpan gónadas. Exámenes complementarios: FSH: 0.5 LH: 0.3 U/L. Testosterona: 2.1 al nacimiento. 17OH pg: 5.29 MIF: 164 pmol/L. Cariotipo de alta resolución: 45X0 en 58% de líneas celulares; 46 X idic. en el 40%; 46 XY en el 2%. Cariotipo de los padres normal. RMM: imagen tubular compatible con útero rudimentario. No se identifica gónada izquierda, imagen compatible con gónada derecha. CUMS: vejiga y uretra sin alteraciones; no existe RVU. Test de bHCG: con 2500 UI: testosterona basal: 1.3 pico 3.3. Laparotomía: gónada izquierda compatible con ovoteste con restos de trompa, túbulos seminíferos en los que sólo se identifican células de Sertoli, estroma ovárico y folículos primarios; gónada derecha: tejido testicular con células de Sertoli en canal inguinal. Asignación de sexo masculino con orquidopexia de gónada derecha y extirpación de ovoteste.
Comentarios: 1.- La asignación de género en estos casos es difícil y debe tener en cuenta varios factores: aspecto genital, anatomía urogenital, riesgo de malignidad gonadal, funcionalidad sexual en la vida adulta y aspectos psicosexuales. 2.- Ante la amplia variedad de fenotipos posibles, es importante determinar la proporción de cada línea celular en tejido gonadal así como la asociación con mutaciones del gen SRY.
P1/d2-3-053 CARACTERÍSTICAS DIAGNÓSTICO-TERAPÉUTICAS EN LOS TUMORES TESTICULARES Y PARATESTICULARES EN NIÑOS Y ADOLESCENTES. M.L. Fernández Pérez, M.T. Muñoz-Calvo, M. García-Ros, J. Rodríguez de Alarcón, F.J. Caballero Mora, J. Argente.
Hospital Infantil Universitario Niño Jesús. Servicio Endocrinología, Madrid.
Los tumores testiculares en la infancia constituyen alrededor del 1% de los tumores sólidos. Objetivo: Investigar la incidencia y características de los tumores testiculares y paratesticulares en la edad pediátrica.
Métodos: Se estudian retrospectivamente 15 casos de tumores testiculares diagnosticados en los últimos 20 años. Se recogieron los siguientes datos: edad, forma de presentación clínica, metodología diagnóstica, estudio anatomopatológico, tratamiento y seguimiento.
Resultados: La edad media de los pacientes fue de 9,5 años (rango 0,58-16 años), siendo prepuberales el 40% (edad media 1,9 ± 1 año) y puberales el resto (edad
Conclusiones: 1. La mayoría de los tumores testiculares derivan de las células germinales y no encontramos relación con la edad de presentación. 2. Existe una distribución bimodal, con un pico antes de los 6 años, siendo el teratoma quístico el más frecuente, y después de los 13 años, destacando el rabdomiosarcoma.
P1/d2-3-054 PUBERTAD PRECOZ Y PATOLOGÍA TUMORAL. M.J. Rivero Martín(1), M.J. Alcázar Villar (1), N. Nieto Gabuccio (1), M. Sanz Fernández (1), M. Cueto Callejón (2), M.J. Muñoz Casado (3).
(1) Servicio de Pediatría. Hospital Universitario de Fuenlabrada, Madrid. (2) Servicio de Ginecología. Hospital Universitario de Fuenlabrada, Madrid. (3) Servicio de Neurocirugía. Hospital Universitario 12 de Octubre, Madrid. Introducción: Se define la pubertad precoz como la aparición de caracteres sexuales antes de los 8 años en niñas y antes de los 9 en varones. La pubertad precoz puede ser de origen central (98%) o periférico (2%). En ambos casos, aunque conocida, la etiología tumoral es infrecuente. Se presenta un caso de pubertad precoz central y uno de pubertad precoz periférica con patología tumoral.
Caso 1: Niña de 8 años con inicio de pubarquia, acné y cambio del olor corporal a los 7 años y 3 meses, aparición de telarquia 3 meses después. Antecedentes familiares: madre menarquia a los 9 años. Exploración física: desarrollo mamario y pubarquia 2 de Tanner. Pruebas complementarias: LH/FSH: 0.6/3.5 UI/L, estradiol 60 pg/ml. Edad ósea: 11 años (+4.5 DE). Ecografía pélvica: útero tubular, volumen de 3.1 cc, volumen ovárico 1.6 cc, pequeños microquistes. RNM: tumoración supraselar de 15 mm sugestiva de astrocitoma pilocítico.
Caso 2: Niña de 9 años remitida por sangrado vaginal. Refieren pubarquia y axilarquia desde los 8 años y telarquia de tiempo indefinido. Intervenida a los 15 meses de edad de canal atrioventricular, sin tratamiento actual. Edad de menarquia de la madre 13 años, hermano de 15 años con inicio de caracteres sexuales a los 11 y medio años. Exploración física: mama en estadio 3 de Tanner, pubarquia y axilarquia en estadio 2. Pruebas complementarias: edad ósea de 11 años (>2DS). LH/FSH: 0.2/1.9 UI/L, estradiol 49 pg/ml. Ecografía pélvica: tumoración en FID de 62x54mm tabicada, tabique fino sin vascularizar y polo sólido de 21 mm con imágenes refringentes, útero infantil de 44 mm y ovario izquierdo retrouterino de 9 mm. TAC abdominal: Lesión pélvica compleja de 5,6 x 5 cm, en la teórica localización del anejo derecho que presenta tres componentes (líquido, grasa y calcio) sugerente de teratoma de ovario dcho. Estudio de extensión negativo, marcadores tumorales alfa-fetoproteína 12 ng/ml (<5), Ag CA 19.9 40 UI/ml (<30), resto negativo. Estudio histológico: teratoma maduro.
Comentarios: Aunque infrecuente, no debemos olvidarnos de la patología tumoral como causa de pubertad precoz. La progresión rápida con aceleración importante de la edad ósea son signos de alarma.
P1/D2-3-055 PSEUDOPUBERTAD PRECOZ Y PUBERTAD N. Villarreal Peña(1), A. Cordón Torell (1), J.M. Ribó Cruz (2), M. Suñol Capella (2), C. Pavía Sesma (1).
(1) Hospital de Nens de Barcelona; (2) Hospital Universitario Sant Joan de Déu, Barcelona.
Dos niñas son evaluadas por desarrollo mamario y aumento del crecimiento en talla a la edad de 6 años (caso 1) y 8 años y 4 meses (caso 2). Ambas niñas son producto de gestaciones a término con peso y longitud adecuados. Antecedentes familiares no relevantes. Las niñas presentan signos clínicos de desarrollo puberal: S2, el resto de la exploración es normal. Las características antropométricas y la maduración ósea se describen en la tabla 1. En la tabla 2 se describe el test de Triptorelina. Los marcadores tumorales fueron negativos y la ecografía mostró un nódulo ovárico izquierdo en el caso 1 y tumor mixto retrovesical en el caso 2.
Se realizó ooforectomía izquierda en ambas pacientes:
Caso 1: Tumor de Células de la Granulosa Juvenil (TCGJ), cápsula íntegra. Positivo para vimentina, alfa- inhibina y CD99. Índice de proliferación: 5%. No hay células malignas en líquido peritoneal.
Caso 2: Teratoma quístico maduro (TQM) con tejido meso-dérmico, endodérmico y ectodérmico, ausencia de atipias. Comentarios: El TCGJ representa menos del 5% de los tumores ováricos en niñas. La telarquia precoz es frecuente; ocasionalmente aparecen metrorragia o signos de virilización abruptos. Este caso es un estadío I A con una supervivencia > 97%. Las recidivas se presentan en los primeros 2 años.
El TQM es un tumor benigno originario de células germinales. La recurrencia es < 10%. En ambos casos, han regresado los signos clínicos puberales, ha disminuido la velocidad de crecimiento y la maduración ósea. Los controles ecográficos al cabo de un año son normales.
P1/d2-3-056 PUBERTAD PRECOZ PERIFÉRICA ISOSEXUAL SECUNDARIA A CARCINOMA SUPRARRENAL EN VARÓN DE 3 AÑOS CON MACROGENITOSOMÍA. M.A. Fuentes Castelló (1), P. Belda Benexiu (1), X. García Serra (1), C. Esquembre (2), F. Vargas Torcal (1).
(1) Hospital General Universitario de Elche (Pediatría), Elche, (2) Hospital General Universitario de Alicante (Oncología Infantil), Alicante.
Introducción: Los tumores suprarrenales suponen 0,2-0,3% de las neoplasias pediátricas (0,3 casos por cada millón de menores de 15 años); en varones aún son más infrecuentes.
Caso Clínico: Varón de 3 años con pubarquia precoz de 4 meses de evolución y macrogenitosomía, cuyo tiempo de evolución, por examen de fotos previas del paciente, era menor de un año. No axilarquia ni cambio del olor corporal. No otra sintomatología. Expl. física: Desarrollo del pene en estadío IV de Tanner, vello púbico en estadío II. Testes infantiles (3 cc). No hiperpigmentación. Talla: p75; Peso: p90; IMC: 19.
Discusion: La precocidad del diagnóstico es vital para mejorar el pronóstico. El diagnóstico diferencial, al margen de la pubertad precoz central (que conllevaría desarrollo gonadal), abarca la hiperplasia suprarrenal congénita; la secreccion ectópica de ß-hCG (de fuente tumoral habitualmente); la mutación hiperactivadora del receptor de LH conocida como Testotoxicosis. En estas dos últimas entidades hay aumento del volumen testicular (aunque siempre escaso en relación al desarrollo peneano) dependiente de la hiperplasia de las células de Leydig (nuestro paciente tenía unos testes completamente infantiles).
P1/d2-3-057 DISGENESIA GONADAL MIXTA ASOCIADA A HIPERPLASIA SUPRARRENAL Y DÉFICIT DE HORMONA DE CRECIMIENTO. M. Rivero Falero, V. Gómez Rodríguez, N. Álvarez Martín, S. González Cerrato, L. Pérez Baena, J.M. Rial Rodríguez.
Hospital Universitario Nuestra Señora de Candelaria, Santa Cruz de Tenerife.
Presentamos el caso clínico de un paciente diagnosticado sucesivamente de disgenesia gonadal, hiperplasia suprarrenal no clásica y déficit de hormona de crecimiento.
Paciente varón de 3 años de edad con criptorquidia e hipospadias, remitido a consulta para estudio hormonal. Antecedente de crecimiento intrauterino retardado. A la exploración física destaca hipospadias severo con escroto bífido, pene escrotalizado y criptorquidia izquierda. Se indica orquidopexia pero durante la intervención, ante el aspecto hipoplásico de la gónada y disyunción epidídimo-testicular se decide exéresis, objetivándose en la anatomía patológica segmentos de trompas de Falopio y cuerpo uterino inmaduros. Se realiza cariotipo que muestra 10% 46XY, 90% 45 XO diagnosticándose de disgenesia gonadal mixta. Es intervenido nuevamente para extirpar la gónada contralateral, que se comprueba displásica.
Simultáneamente se solicita perfil suprarrenal apreciando niveles elevados de 17OH-progesterona, y confirmándose tras test de ACTH el diagnóstico de déficit de 21-hidroxilasa no clásica. En el estudio genético aparece mutación severa p.Ile172Asn en un alelo, con secuenciación normal del resto de la región codificante.
Durante su seguimiento presenta disminución de la velocidad de crecimiento, situándose la talla a -2ds de la media. Se comprueba respuesta deficitaria de HGH a los estímulos de propranolol y de clonidina. A los nueve años y medio se inicia tratamiento con hormona de crecimiento, conjuntamente con hidrocortisona por la aceleración de la maduración ósea (11 años) secundaria al déficit de 21 hidroxilasa. Se observa rápida recuperación de talla, alcanzando percentil 10 a los 15 años.
Desde los 13 años recibe tratamiento con testosterona. Se ha sometido a nueva intervención para la colocación de prótesis testicular bilateral. El paciente muestra buena adaptación social, buen rendimiento académico y deportivo, y comportamiento coherente con su rol masculino.
Conclusiones: - El diagnóstico de disgenesia gonadal en este caso fue tardío, condicionando las posibilidades de elección de sexo. - La concurrencia del déficit de 21 hidroxilasa motivó una aceleración de la maduración ósea, siendo necesario el tratamiento con hidrocortisona para mejorar su talla final. - La velocidad de crecimiento después de iniciar el tratamiento con HGH se corresponde con la respuesta esperada en un déficit clásico. - La coincidencia en un mismo paciente de los tres diagnósticos es excepcional y fortuita, no habiendo sido descritos otros casos hasta el momento.
P1/d2-3-058 IMPORTANCIA DEL DIAGNÓSTICO Y ASESORAMIENTO PRECOZ EN EL SÍNDROME DE INSENSIBILIDAD COMPLETA A LOS ANDRÓGENOS (CAIS). M.C. Ontoria Betancort (1), M. López García (1), I. García Camiñas (1), A. Moleiro Bilbao(2), N. Hernández-Siverio González(2), J.P. González Díaz (1).
(1) Servicio de Pediatría, Hospital Universitario de Canarias. La Laguna. Tenerife; (2) Servicio de Cirugía Pediátrica. Hospital Universitario de Canarias. La Laguna, Santa Cruz de Tenerife.
Introducción: El síndrome de insensibilidad completa a los andrógenos (CAIS) es una enfermedad genética de transmisión recesiva ligada al cromosoma X (30% mutaciones de novo), producida por mutaciones en el receptor de andrógenos que conducen a un severo deterioro en la función de éste. Son individuos con cariotipo 46 XY, en los que a pesar de una producción normal de testosterona no virilizan normalmente, por lo que su fenotipo es femenino, con genitales externos normales. El diagnóstico en época prepuberal se produce tras estudio de masa (teste) intraabdominal o inguinal, y en época puberal por la ausencia de desarrollo sexual.
Caso Clínico: Paciente de 2 años de edad, seguida en la consulta de Cirugía Pediátrica por hernia inguinal derecha. Exploración física: peso 12,100 Kg (P 75), talla 90,5 cm (P 95), IMC 14,9%; fenotipo normal, mujer, genitales externos normales femeninos, hernia inguinal derecha no reductible. Tras programación reglada, se lleva a cabo intervención quirúrgica encontrando masa de aspecto gonadal a nivel del trayecto inguinal derecho; tras tomar muestra histológica, se deja en bolsa subcutánea en labio mayor derecho. En el mismo acto quirúrgico se realiza laparoscopia exploradora a través del anillo inguinal interno, no visualizándose ovarios ni útero, pero sí otra estructura de aspecto gonadal similar a la descrita en el trayecto inguinal, en situación retroperitoneal. Tras estos hallazgos, posteriormente se realizan los siguientes exámenes complementarios: Citogenética: 46 XY. Genética molecular: positivo para CAIS (homocigosis de un cambio c.2255 G>A que da lugar a un cambio aminoacídico p.Arg752Gln (p.R752Q)). Histología: testículos en estadío prepuberal. Ecografía pélvica: imágenes sugestivas de testes, el derecho en conducto peritoneovaginal, de 8 mm, así como izquierdo, a nivel más alto, inguinal (1.9 cm, con presencia de epidídimo). Con maniobra de Valsalva se visualiza herniación de teste izquierdo hacia cavidad peritoneal. No se evidencian órganos genitales internos femeninos.
Comentarios: 1) ¿Los hallazgos exploratorios quirúrgicos son indicativos de gonadectomía? 2) ¿La citogenética es determinante del sexo y su educación? 3) ¿La genética molecular implicaría consejo genético a los progenitores? 4) ¿El diagnóstico precoz de esta situación clínica llevaría a un mejor asesoramiento familiar y manejo evolutivo psicosexual?
P1/d2-3-059 PATOLOGÍA OVÁRICA TUMORAL EN NIÑAS Y ADOLESCENTES. A. Castroviejo Gandarias, M. Chueca Guindulain, S. Berrade Zubiri, M. A. Martínez Bermejo, M. Aliaga Marín, M. Oyarzábal Irigoyen.
Hospital Virgen del Camino, Pamplona.
Introducción: Los tumores ováricos son raros en pediatría, estimándose una incidencia de 2,6 casos/100.000 niñas/año. El 35% son malignos, y suponen el 1% -1,5% de los cánceres infantiles. Esta patología presenta una clínica variable e inespecífica, por lo que el diagnóstico suele ser tardío.
Material y Métodos: Análisis retrospectivo de las historias clínicas de las niñas con este diagnóstico en los últimos 5 años en un Hospital terciario. Se recogen: clínica, edad, desarrollo puberal, diagnóstico, tratamiento y evolución.
Resultados: Entre 2005-2010 se han diagnosticado 27 lesiones tumorales ováricas. Edad media 11 años (rango 1 mes - 16 años). 23 fueron benignas (85%) y 4 malignas (15%). Entre las lesiones benignas el 77,9% no neoplásicas (quistes foliculares, hemorrágicos o paraováricos) y el 7,4% neoplásicas (2 casos de teratoma maduro). 4 pacientes presentaron tumores malignos (rabdomiosarcoma embrionario, teratoma inmaduro, tumor mixto de células germinales y de estroma y tumor de células granulosas). El 33% de los tumores ováricos (n=9) se dieron en niñas prepuberales, siendo 3 casos malignos; el 66% en niñas postpuberales (n=18), siendo 1 caso maligno. Presentación clínica al diagnóstico: dolor abdominal (62,9%, n=17), tumor palpable (14,8%, n=4), hallazgo casual (14,8% n=4), pubertad precoz (3,7%, n=1) y fiebre de origen desconocido (3,7%, n=1). No precisaron ningún tratamiento 7 casos; se realizó cirugía en 20, conservando el ovario contralateral. En 26 casos se consiguió curación y 1 sigue en tratamiento quimioterápico.
Conclusiones: La mayoría de los tumores ováricos en edad pediátrica son lesiones funcionales benignas, y sobre todo en niñas postmenárquicas. El dolor abdominal es la presentación más frecuente. Clínica atípica (fiebre prolongada, pubertad precoz, tumor palpable) en niñas prepuberales se asocia más frecuentemente con malignidad. En esta serie, la evolución ha sido satisfactoria y con preservación de tejido ovárico contralateral.
P1/d2-3-060 DISGENESIA GONADAL CON CARIOTIPO 47 XYY. CASO NO DESCRITO PREVIAMENTE EN LA LITERATURA. I. Díez López(1), A. Sarasua Miranda (1), I. Bilbao González (3), L. Fernando Galera Moreno (2).
Sección de Endocrinología Pediátrica (1), Servicio de Ginecología (2) y de Urología (3). Hospital de Txagorritxu, Vitoria (Álava).
Las disgenesias gonadales pueden provocar alteraciones fenotípicas, muchas detectables al nacimiento. Presentamos el caso de una paciente que consulta con una importante demora; y con un cariotipo en relación al fenotipo interno/externo no descrito hasta la fecha. (Con amplia iconografía para su ilustración).
Motivo de consulta: Paciente de 14 años de edad que consulta por ausencia de telarquia e hirsutismo.
Antecedentes familiares: Madre con hirsutismo, sin repercusión menstrual y fértil. Talla baja familiar.
Antecedentes personales: Embarazo y parto normales. Somatometría al nacimiento normal. Ingreso en Unidad Neonatal por distress en el periodo neonatal. No consta en informes alteraciones genitales. Crecimiento y desarrollo madurativo normal. Adrenarquia a los 8 años, de evolución rápidamente progresiva. Acné moderado. Exploración física: Peso P90, talla P25, fenotipo peculiar con aspecto Turneriano. Hirsutismo (Ferriman 12 puntos). Tanner: A5P5T1. Clitoromegalia de aspecto peniforme, sin meato urinario terminal. Grado III de Prader. Conductos inguinales normales. Vulva normoconfigurada. Himen permeable.
Pruebas complementarias: TSH 1.98µU/mL, FSH 51.6UI/L, LH 33.2UI/L, Estradiol 13.3pg/mL, Testosterona total 10.41ng/mL, SHBG 52.92nmol/L, DHEA Sulfato 174mcg/dL, Testosterona Libre Calculada 19.3pg/mL, 11-Desoxicortisol Basal 2.4ng/mL, Dehidroepiand. Basal 5.7ng/mL, Insulin Like Growth Factor 3 4.25mcg/mL, 17-OH-Pregnenolona Basal 2.29ng/mL, Somatomedina C 126ng/mL, 17-OH-Progesterona 1.64ng/mL, Insulina 2.5mcU/mL, D4 Androstendiona 2.01ng/mL, Alfa-feto-proteína 5.4UI/mL, Beta-HCG 0.7UI/L. Cariotipo Sangre Total: Estudio citogenético (30 metafases - resolución 400 bandas), se observan dos líneas celulares. 47,XYY[28] / 45,X[2]
Ecografia genital Útero: Imagen compatible con útero de pequeño tamaño de 40 x 20 x 8 mm. Endometrio: Lineal. Anejo derecho y anejo izquierdo: Imágenes sin folículos de 15 x 5 mm. Test de LHRH: respuesta de elevación de testosterona. Exploración ginecológica por laparoscopia: Útero y trompas normales. Anejo izquierdo compatible con testículo. Entre fimbrias y trompa derecha formación similar. Biopsia de tejidos: compatibles con tejido testicular.
Gonadectomía bilateral por vía laparoscópica. Muestras gonadales (Reference Lab): cariotipo 47 XYY.
Evolución: Se decide estrogenización rápida (etinilestradiol VO y progesterona combinada) consiguiendo tras 6 meses de evolución tras cirugía descenso de testosterona basal, mejoría parcial del vello corporal, desarrollo de la telarquia grado III y mejora de la autoestima. Clitoromegalia pendiente de reevaluar.
P1/d2-3-061 GONADOBLASTOMA BURNED-OUT EN PACIENTE CON MOSAICO 45 XO/46XY. M.D. Rey Cordo (1), C. Melcón Crespo (1), A. González Piñeiro (2), J. L. Chamorro Martin (1), D. González Lestón (1).
(1) Complexo Hospitalario Universitario de Vigo. Servicio de Pediatría, Endocrinología Pediátrica; (2) Servicio de Anatomía Patológica, Pontevedra.
La presencia de material Y en las disgenesias gonadales se asocia con mayor riesgo de presentar gonadoblastoma. Se recomienda por lo tanto en estas pacientes la gonadectomía profiláctica.
Caso clinico: Paciente de 9 años que consulta por talla baja. Intervenida de hipertrofia amigdalar y de adenoides.
Exploración física: Talla 123 cm (-2.41 DS). Peso 23.8 Kg (-1.45 DS). Facies peculiar: filtrum corto, mordida abierta. Mamilas separadas. Prepuberal.
Exploraciones complementarias: Hemograma, bioquímica, anticuerpos antitransglutaminasa: sin hallazgos patológicos. Perfil tiroideo: normal. IGF-1 127.5 ng/mL; IGFBP3 4.1 mg/L. Edad ósea compatible con cronológica. Cariotipo 45X (31)/46 XY(25). Gen SRY en células XY: presente. Resonancia magnética pélvica: útero hipoplásico rudimentario. No se llegan a identificar gónadas. Estudios cardíaco y oftalmológico normales.
Evolución: Se decide exploración laparoscópica y ooforectomía-salpinguectomía bilateral. Ambas gónadas presentan abundantes calcificaciones esféricas, bilaterales, sugestivas de gonadoblastoma con calcificación masiva (Burned-out gonadoblastoma), sin evidencia de neoplasia maligna de células germinales. Estudio de extensión con marcadores tumorales y resonancia magnética abdominal/hepática: negativos.
Conclusiones: La gonadectomía en pacientes con disgenesia gonadal con potencial virilizante (material Y positivo), está indicada y no parece que pueda sustituirse por el seguimiento con resonancia y/o ecografía por la posibilidad de falsos negativos.
P1/d2-3-062 ESTUDIO DESCRIPTIVO DE PUBERTAD PRECOZ DURANTE LOS ÚLTIMOS 5 AÑOS EN UN HOSPITAL COMARCAL. M.J. Romero Egea, A. Almansa García, R. Salinas Guirao, L. Martínez Marín, MT. Montero Cebrian, MI. Martínez Llorente.
Hospital Rafael Méndez. Lorca, Murcia.
Introducción: La pubertad es un periodo de transición entre la infancia y la edad adulta. Las alteraciones en el inicio y progresión de la pubertad afectan tanto a aspectos psicosociales del niño como a su pronóstico de crecimiento. Los agonistas de GnRH son la base del tratamiento de la pubertad central, pero su eficacia real sobre la talla final es aún hoy poco clara.
Objetivos: Estudio descriptivo de los casos de pubertad precoz, pubertad adelantada y tratados con análogos de GnRH atendidos en la consulta de endocrinología infantil de un hospital comarcal durante los últimos 5 años.
Metodología: Estudio retrospectivo de los casos de pubertad precoz y de pubertad adelantada mediante revisión de historias clínicas.
Resultados: Se recogieron un total de 72 casos (2 varones): 15 pubertades precoces centrales idiopáticas, 32 pubertades adelantadas, 21 pubertades precoces/adelantadas secundarias y 4 telarquias aisladas. El motivo de consulta en 4 casos fue de sangrado vaginal. Ningún caso era adoptado y 7 pacientes eran inmigrantes. Se trataron 22 casos (1 varón) con análogos de GnRH (triptorelina), el 93% de las PPC, el 15.5% de las P. adelantadas y el 14% de las P. secundarias. El 48% tenían antecedentes familiares de pubertad precoz o adelantada. La edad ósea estaba adelantada en más de 2 años en 11 casos. El pronóstico de talla adulta (PTA) al diagnóstico era inferior a 155 cm en 14 casos e inferior a la talla diana en más de 5 cm en 12 casos. En 20 casos se realizó un test de GnRH (puberal en 17 casos) y una ecografía pélvica (datos de pubertad en 13 casos). Se realizó RM cerebral en 18 pacientes. Actualmente han finalizado el tratamiento 13 pacientes que se trataron durante 1,5 +/- 1 años. No disponemos de talla final adulta pero el PTA al final del tratamiento ha mejorado en más de 4,5 cm en 9 pacientes (media de incremento de PTA: 5,4 cm).
Conclusiones: La pubertad adelantada es más frecuente que la pubertad precoz, tratándose sólo un pequeño porcentaje de la pubertad adelantada. En nuestra serie hemos observado un aumento en la predicción de talla adulta en el 69% de los pacientes tratados aunque no disponemos de datos de talla final alcanzada para saber realmente sí estos valores se encuentran o no sobreestimados.
P1/d2-3-063 ANOMALÍA DE LA DIFERENCIACIÓN SEXUAL XY EN GEMELOS. A.. De La Puente Arévalo(1), E. Bermúdez de Castro López (1), L. Salamanca Fresno (1), E. Barroso (2), KE. Heath (2), R. Gracia Bouthelier (1).
(1) Servicio de Endocrinología Infantil, Hospital Universitario La Paz, Madrid; (2) Instituto de Genética Médica y Molecular (INGEMM), Hospital Universitario La Paz, Madrid. Presentamos el caso de dos recién nacidos gemelos con ambigüedad de genitales externos. Respecto a los antecedentes obstétricos destacar que se trata de un embarazo por fecundación in vitro, con donación de óvulos y esperma del padre.
En cuanto a los antecedentes familiares señalar que el padre había sido intervenido de hipospadias en la infancia y se había realizado exéresis de un seno urogenital.
El primer gemelo presentaba una antropometría acorde a su edad gestacional y en la exploración física destaca un pene de 1,5 cm con hipospadia perineal, escroto en chal no pigmentado, palpándose estructuras intraescrotales bilateralmente de aproximadamente 1 cc con escaso hidrocele.
El segundo gemelo fue un crecimiento intrauterino retardado armónico y en la exploración física destaca unos genitales externos no hiperpigmentados, con estructura peneana de 1,5 cm, seno urogenital, bolsas escrotales con escasos pliegues donde se palpa únicamente la gónada izquierda de 0,5 cc. En cuanto a las exploraciones complementarias se llevó a cabo un cariotipo que fue 46XY en ambos pacientes, un estudio hormonal donde destaca una hormona antimulleriana baja en ambos. Ecografías pélvico-abdominales: normal en el primer gemelo mientras que el segundo gemelo presentaba ambos testes en los conductos inguinales saliendo de la cavidad abdominal y por detrás de la vejiga parecía existir un útero muy rudimentario y vagina confirmándose su existencia en una resonancia magnética pélvico-abdominal. Se extrae estudio genético de ambos pacientes y el progenitor para identificar mutaciones en los genes implicados en la diferenciación sexual normal. Se ha identificado una mutación en el gen SF1 (también llamado NR5AI) en el padre y en ambos pacientes.
Se trata de un caso de anomalía de la diferenciación sexual XY debido a una mutación no descrita hasta la fecha en el gen SF1 heredada del padre.
P1/d2-3-064 PUBERTAD PRECOZ Y MASA PINEAL. A.C. Barreda Bonis(1), J. Guerrero-Fernández (1), L. Salamanca Fresno (1), M.A. Molina (1), I. González Casado (1), R. Gracia Bouthelier (1).
(1) Servicio de Endocrinología Infantil, Hospital Universitario La Paz, Madrid. Introducción: Las lesiones en la glándula pineal suponen el 3-11% de los tumores intracraneales pediátricos. Dentro de su sintomatología pueden ocasionar pubertad precoz (PP) (<10%casos) mediante diferentes mecanismos, entre ellos vía ß-hCG en el caso de tumores de estirpe germinal. Presentamos el caso de un varón con PP por ß-hCG y disgerminoma pineal.
Caso: Varón de 9 años que en contexto de cefalea orgánica de 3 semanas de evolución acude a urgencias, se realiza TC donde se objetiva masa pineal e hidrocefalia. Se interconsulta a nuestro servicio. Inicio de pubarquia, olor apocrino, acné y crecimiento del pene y testículos hace 6 meses. Estirón hace 3 meses.
Antecedentes personales: Sin interés.
Antecedentes familiares: Madre menarquia a los 11-12 años. Padre pubertad normal. Talla diana:176 ± 5cm
Exploración física: Peso 47,3 kg (p90) Talla 148.5 cm (p90) Velocidad de crecimiento: 3.5 cm en 3 meses (14 cm/año). Acné, olor apocrino llamativo, Tanner III, pubarquia II-III con testes de 6 cc el izquierdo, 8 cc el derecho, pene engrosado
Eje hipotálamo-hipofisario: TSH 0.75uUI/mL, T4L 1.27ng/dl y PRL 10.49ng/mL (normales), IGF-1 369ng/mL, BP3 5.26ug/mL (adecuados a Tanner), ACTH <5pg/mL, cortisol basal <1ug/mL (suprimido debido a tratamiento para la hipertensión intracraneal con dexametasona exógena), test de LHRH (0-30-60-90minutos): FSH 0.18-0.28-0.28-0.28mUI/mL; LH<0.1-0.1-0.1-0.1mUI/Ml (pubertad gonadotropin-independiente) Edad ósea: 11 años.
Dada la posibilidad de tumor germinal se realizan marcadores: α-fetoproteína en suero 1.71ng/mL (VN:0-16) y en LCR<0.40 ng/mL (VN<0.5) y ß-hCG en suero 61mUI/mL (VN:0-5) y en LCR 66mUI/mL (VN<1), por lo que nos encontramos ante una pubertad precoz inducida por ß-hCG.
Se interviene quirúrgicamente con colocación de válvula de derivación ventriculoperitoneal. Anatomía patológica: disgerminoma. Posteriormente recibe quimioterapia (etopósido, cisplatino e ifofosfamida) y radioterapia holocraneal.
Al mes testosterona basal 2.52ng/mL, FSH 3.30, LH 4.39mUI/mL. Posteriormente infantil hasta los 5 meses postintervención con testosterona basal 2.13ng/mL, FSH 4.09, LH 2.28mUI/mL. Edad ósea: 13 años. Actualmente en remisión con progresión de pubertad. Comentario: Las lesiones en glándula pineal pueden ocasionar PP gonadotropin-dependiente: por disminución de la melatonina (que inhibe la secreción de GnRH) o por alteraciones en la circulación del LCR; o bien gonadotropin-independiente mediante secreción de sustancias LH-like (ß-hCG), como en nuestro caso, imitando una PP central al aumentar el volumen testicular
P1/d2-3-065 DISGENESIA GONADAL PURA E INSUFICIENCIA OVÁRICA PRECOZ. A. Bartucci (1), A.C. Barreda Bonis (1), M.A. Molina (1), E. Barroso (2), K.E. Heath (2), R. Gracia Bouthelier (1). (1) Servicio de Endocrinología Infantil, Hospital Universitario La Paz, Madrid; (2) Instituto de Genética Médica y Molecular (INGEMM), Hospital Universitario La Paz, IdiPAZ, UAM y CIBERER, ISCIII, Madrid.
Introducción: Cada vez son más los genes conocidos involucrados en la diferenciación gonadal, tanto para la formación del testículo como del ovario. La disgenesia gonadal pura o síndrome de Swyer es una alteración de la diferenciación sexual con cariotipo XY. En ella se forma una gónada disgenética, que conlleva diferente grado de desarrollo de carácteres sexuales secundarios, desde la ausencia completa hasta un fenotipo femenino normal, y ocasionalmente signos de virilización como hipertrofia de clítoris, en cuyo caso habrá que pensar en tumor sobre la gónada disgenética. Existen diferentes genes implicados tales como el SRY, DMRT1-2, WT1, WNT4, DAX1… algunos a su vez participan en el desarrollo de la gónada indiferenciada a ovario.
Presentamos el caso de un paciente con cariotipo XY afecto de disgenesia gonadal pura, con antecedente materno de fallo ovárico precoz, y desarrollo de neoplasia in situ evidenciado tras la gonadectomía profiláctica.
Caso: Presentamos el caso de una niña que consulta a los 13.7 años por retraso puberal. En la exploración Tanner 1, T1P4A-, clítoris hipertrófico. Antecedentes personales: Madre menarquia 16 años con menopausia precoz 34 años (anticuerpos antiovario negativo) y tío materno infértil. Exámenes complementarios: Analítica compatible con hipogonadismo hipergonadotrópico, test HCG con ausencia de MIF, ecografía ginecológica: utero hipoplásico y ovarios atróficos. Se realiza densitometría ósea (columna lumbar) que demuestra osteoporosis Mediante laparoscopia se extirpan testes disgenéticos y se objetiva neoplasia intratubular indiferenciada de celulas germinales. Estudios genéticos: Cariotipo 46,XY. Se secuencian genes SRY, SF-1, SOX9, DAX1, DHH y DMRT1 siendo el resultado negativo.
Comentarios: Pensamos que en esta familia existiría alguna alteración genética que explicase la disgenesia gonadal pura del caso y la insuficiencia ovárica precoz de su madre. Son necesarios más estudios que clarifiquen aquellos genes compartidos en el desarrollo testicular y ovárico.
P1/d2-3-066 TUMOR DE CÉLULAS DE SERTOLI EN UN PACIENTE PEDIÁTRICO. E. Bermúdez de Castro López(1), A. De La Puente Arévalo(1), A.C. Barreda Bonis (1), M. Nistal (2), I. González Casado (1) , R. Gracia Bouthelier (1).
(1) Servicio de Endocrinología Infantil, Hospital Universitario La Paz, Madrid; (2) Servicio de Anatomía Patológica, Hospital Universitario La Paz, Madrid.
Introducción: Los tumores de células de Sertoli representan menos del 1% de los tumores testiculares en niños. Más del 90% son de carácter benigno. Pueden ser bilaterales y producir signos mixtos de masculinización y feminización en el periodo prepuberal y ginecomastia en el adulto. En ocasiones se asocian al síndrome de Peutz Jeghers o al complejo de Carney.
Caso clínico: Varón, de origen venezolano y sin antecedentes personales ni familiares de interés, al que a los 2 años se realizó una orquidectomía derecha en su país de origen tras observar una masa en el testículo. La anatomía patológica fue compatible con un tumor de células de Sertoli. En ecografías posteriores de control, se observaron microcalcificaciones en el testículo remanente. A los 10 años se le extirpó un nuevo tumor de células de Sertoli situado en el polo superior del testículo izquierdo. Antes de esta intervención los niveles de hormona antimulleriana estaban elevados (238 pmol/l), disminuyendo posteriormente. Los marcadores tumorales (ßHCG y αFP) fueron negativos. A los 11 años y 7 meses acude a nuestra consulta para seguimiento. En este momento en la exploración destaca un pene de 5 cm de longitud, engrosado, bolsa derecha hipoplásica, sin teste y bolsa izquierda bien desarrollada, con teste de 6-8 ml, duro. No axilarquia, mínima pubarquia. En la ecografía se observa un teste izquierdo de 2,8 x 1,4 x 2,5 cm, con numerosas imágenes ecogénicas en su estroma. Tenía una edad ósea de 10 años, una testosterona de 0,36 ng/ml y hormona antimulleriana de 12,39 ng/ml. El test de Luforán mostró una FSH basal de 8 mUI/ml con pico de 11,14 mUI/ml y una LH basal de 2,78, con pico de 8,40 mUI/ml. Desde este momento se realiza vigilancia clínica, ecográfica y analítica.
Discusión: La mayoría de los tumores de células de Sertoli son benignos, aunque está descrito algún caso de metástasis y, en ocasiones, debido a su localización multicéntrica, pueden comprometer el tejido testicular normal. Debido a ello, el tratamiento en estos pacientes es controvertido y se debate entre la actitud expectante y la orquidectomía radical.
P1/d2-3-067 AMENORREA PRIMARIA: A PROPÓSITO DE DOS CASOS DE SÍNDROME DE ROKITANSKY. S. Congost Marín(1), J.I. Perales Martinez (1), A. de Arriba Muñoz (1), N. Martín Ruiz (1), E. Mayayo Dehesa (1), M.E. Ballesteros Moffa (2).
(1) Servicio de Endocrinología Pediátrica, Hospital Miguel Servet, Zaragoza. (2) Servicio de Ginecologia, Hospital Miguel Servet, Zaragoza.
Introducción: La amenorrea primaria se define como la ausencia de menarquia a los 16 años o 2 años tras el estirón puberal. Se presentan dos casos clínicos controlados en nuestra unidad.
Caso clínico 1: Paciente diagnosticada de tiroiditis autoinmune en tratamiento sustitutivo desde los diez años. En los siguientes años se objetiva desarrollo puberal completo sin presentar la menarquia pese a función ovárica normal y cariotipo 46XX. A los 16 años se remite para exploración ginecológica que aprecia genitales externos normales con himen imperforado, en ecografía un útero hipoplásico y ovarios de tamaño y características normales. Se lleva a quirófano encontrándose ausencia de vagina tras desbridar 2-3 milímetros de himen.
Caso clínico 2: Paciente tratada con hormona de crecimiento durante 3 años por talla baja y antecedente de crecimiento intrauterino retardado lográndose una talla final de 144.5 cm a los 16 años. En la exploración hábito turneriano con desarrollo puberal completo, en analítica presenta hipogonadismo hipergonadotropo (16 años: Estradiol 19 pg/ml, FSH 119.66 U/l, LH 49.14 U/l) y cariotipo 46 XX. Ecografía abdominal: hipoplasia genital, nefropatía crónica bilateral. Se realiza laparoscopia donde se objetiva agenesia uterovaginal con trompas hipoplásicas y pseudocintillas gonadales, se realiza estudio anatomopatológico de ambas cintillas sin identificarse folículos. Se realiza cariotipo de tejido gonadal siendo 46 XX. Comentario: La agenesia vaginal junto con agenesia o hipoplasia del útero constituye el síndrome de Rokitansky. La patogenia es desconocida, aunque se ha visto agrupación familiar. La clínica se suele manifestar en la adolescencia en mujeres con desarrollo puberal completo y amenorrea primaria, siendo la segunda causa de amenorrea tras las disgenesias gonadales. Puede asociarse con anomalías urinarias, gonadales y esqueléticas.
Toda amenorrea primaria no justificada debería ser explorada desde el punto de vista ginecológico para descartar anomalías en el tracto genital.
P1/d2-3-068 ALTERACIÓN DE LA DIFERENCIACIÓN SEXUAL -ADS- (46XX OVOTESTICULAR) EN 3 NIÑOS PROCEDENTES DE MAURITANIA. A. Rodríguez Estévez(1), A. Vela Desojo (1), G. Grau Bolado (1), F. Oliver Llinares (2), J.L. Blanco Bruned (2), L. Castaño González (3).
Endocrinología Pediátrica (1). Urología Pediátrica (2). Unidad de Investigación. CIBERER (3). Hospital de Cruces. Barakaldo (Bizkaia).
Introducción: La presencia histológica de tejido testicular y ovárico en las gónadas de un mismo individuo caracteriza la ADS ovotesticular (OMIM # 235600). El cariotipo más frecuente es 46 XX (60-100%), la mayoría SRY negativo. Se manifiesta con genitales ambiguos al nacimiento. Debe realizarse una biopsia de gónada en todo su eje longitudinal para evitar el diagnóstico erróneo de las formas mixtas (82% diagnóstico de tejido testicular que posteriormente se confirmó eran ovotestes). La frecuencia en el contexto de ADS en África es muy elevada en algunas series amplias (51% Sudáfrica vs 8% en Brasil).
Casos Clínicos: Presentamos 3 casos de ADS ovotesticular procedentes de Mauritania, educados como varones. Acuden para cirugía de genitales ambiguos con preasignación de sexo masculino. Los 3 presentan diferentes grados de micropene e incurvación peneana, hipospadias severo (escrotal o perineal), escroto bífido y criptorquidia unilateral o bilateral. En 2 de ellos se palpa una gónada en conducto inguinal. En la ecografía no se visualiza útero. Valores normales de 17OH-Progesterona y DHEA-S. Cariotipo 46 XX y gen SRY negativo. Se realiza biopsia gonadal en los casos 1 y 3. Pendiente de biopsia y descenso de gónadas en caso 2, diagnóstico macroscópico de ovoteste bilateral. Se confirma presencia de ovoteste derecho y ovario con trompa izquierda en caso 1. En caso 3, el aspecto macroscópico es de ovoteste bilateral sin confirmación histológica (tejido testicular). Se realiza desincurvación con transposición penoescrotal y orquidopexia del teste/ovoteste, con extirpación de gónada y/o genitales internos femeninos si procedía (Caso 1). Posteriormente, uretroplastia en dos tiempos en todos. En Caso 2 tratamiento del micropene con pomada de testosterona 2% con buena respuesta.
Comentarios: En niños de origen africano con genitales ambiguos debemos considerar el diagnóstico de ADS ovotesticular. La forma más frecuente de presentación es el ovoteste (44-64%). Generalmente se reasigna sexo masculino, por tratarse de niños ya educados como varones en su país de origen.
P1/d2-3-069 PUBERTAD PRECOZ (PP) EN NIÑAS. S. Rubio Marcos, A. Larracoechea Zuluaga, G. Grau Bolado, A. Rodrígez Estevez, A. Vela de Sojo, I. Rica Etxebarria.
Endocrinología Infantil. Hospital de Cruces. Barakaldo. Vizcaya.
La sospecha de PP en niñas es una consulta frecuente en endocrinología infantil. Algunos organismos consideran solo PP a aquella que se inicia antes de los 7 años en las niñas de origen caucásico. En contraposición, en la sociedad existe una preocupación creciente ante las variantes de pubertad que consideramos normales.
Objetivos: Conocer el número de consultas por “sospecha de PP” en niñas en un hospital terciario durante la última década y el porcentaje real con diagnóstico de PP. Describir las características de estas ultimas.
Pacientes y Métodos: Revisamos las niñas remitidas por sospecha de PP en la última década [código diagnóstico alta (PP, pubertad temprana y pubertades incompletas) y pacientes en seguimiento en el 2010]. El total de episodios de alta de la consulta entre 2000-2010 fue 3.638. Criterios diagnósticos de PP: desarrollo mamario < 8 años, progresión puberal, avance edad ósea (EO), aceleración del crecimiento y exploraciones complementarias compatibles.
Resultados: La sospecha diagnóstica de PP en niñas constituye el 9,9% de las consultas; el diagnóstico se confirma en el 13,5 % de las sospechas. Comparación clínica entre ambos grupos: Grupo PP: Dos niñas fueron diagnosticadas de pubertad precoz periférica (4,1%). El 91,8% son PP centrales idiopáticas (PPCI). En la resonancia hubo nueve hallazgos radiológicos pero solo dos se consideraron patológicos (4,1%): quiste subaracnoideo y microadenoma. En 19 PPCI disponemos de talla final que supera a la diana en 1.4±0.8 SDS.
Conclusiones: - La PP en niñas constituye el 0.6% de los diagnósticos al alta, siendo la mayoría idiopáticas. La sospecha diagnóstica sin embrago, es una causa frecuente de consulta. - En niñas con PP el porcentaje de adopciones y la talla-SDS en la primera consulta son mayores. - La respuesta tras el tratamiento en PPCI es buena superando la talla final a la diana.
P1/d2-3-070 DIAGNÓSTICO DE SÍNDROME DE KALLMANN EN VARONES EN PERIODO NEONATAL: REVISIÓN DE LOS ÚLTIMOS 15 AÑOS. A. Campos Martorell, L. Vega Puyal, M. Mora Sitjà, M. Clemente León, M. Gussinyé Canyadell, A. Carrascosa Lezcano.
Servicio de Endocrinologia Pediátrica. Hospital Universitari Vall d’Hebron, Barcelona.
Introducción: El síndrome de Kallmann es un hipogonadismo hipogonadotropo aislado caracterizado por déficit de GnRH. Asociado, clásicamente, a trastornos olfatorios (hiposmia/anosmia) debido al origen embriológico del síndrome. Su incidencia en varones es 1/10.000. Presenta gran heterogenicidad clínica y modos de herencia variables con diversos genes implicados (KAL-1, FGFR1, PROKP2…). Existen posibles anomalías asociadas: alteraciones faciales de línea media, sordera neurosensorial, agenesia renal unilateral, sincinesia o disfunción cerebelosa. El diagnóstico suele realizarse por retraso puberal siendo excepcional en el periodo neonatal.
Material y Métodos: Revisión sistemática de historias clínicas con diagnóstico de síndrome de Kallmann. Se identifican cuatro varones con presentación neonatal, edad media al diagnóstico de hipogonadismo hipogonadotropo 70 días de vida (34–128). Diagnóstico mediante analítica hormonal basal y tras beta-HCG, 500UI días alternos, test corto (3 dosis, 1 paciente) o largo (6 dosis, 3 pacientes). Se describen anomalías fenotípicas asociadas y hallazgos en resonancia magnética. Estudio del gen KAL1 (n=3).
Resultados: Datos clínicos al diagnóstico: micropene (n=4), criptorquidia unilateral (n=1) o bilateral (n=1), microtestes (n=1). Analítica hormonal basal (30-115 días vida): testosterona (<20 ng/dl, n=4), LH (<0’38/L, n=4), FSH (<2’2UI/L, n=4) e inhibina B (24-99ng/ml, n=2). Test beta-HCG testosterona tras 3 dosis: 66-247ng/dl, n=3; tras 6 dosis: 441-1079 ng/dl, n=3; en todos, aumento del tamaño peneano (en 2 pacientes >2’5cm). Resonancia Magnética: hipotálamo-hipófisis normal, ausencia de tracto y/o bulbos olfatorios (n=4) e hipoplasia vérmix cerebeloso (n=1). Ecografía abdominal: agenesia renal unilateral (n=1). Tratamiento: testosterona 50mg 3 dosis, si micropene tras test (n=2) con pene de tamaño normal posterior; testosterona dosis progresivas en pubertad (n=1). Estudio gen KAL-1: mutación no descrita, probablemente causante de fenotipo (c.1449+2T>A) n=1; no descrita (c.98G>C) n=1; pendiente n=1. Edad actual: 0.9, 2, 3.8 y 15 años.
Conclusiones: 1. La presencia de micropene y/o criptorquidia bilateral en el neonato, constituye un signo de alarma precoz para el diagnóstico del hipogonadismo hipogonadotropo. En estos casos, debe incluirse el territorio olfactorio en la RM cerebral con el fin de orientar el diagnóstico etiológico. 2. Ante la sospecha diagnóstica del síndrome de Kallmann, se deben buscar posibles anomalías asociadas. 3. El diagnóstico precoz permite realizar tratamiento que normalice el tamaño del pene desde los primeros meses de vida y la posibilidad de diagnóstico molecular, con el fin de realizar consejo genético precoz a la familia.
P1/d2-3-071 SÍNDROME DE NOONAN CAUSA INFRECUENTE DE HIDROPS FETAL. G. Martínez Moya(1), M. De Toro Codes (1), V. Esteban Marfil (1), L. Millán Millares (1), I. Leiva Gea (2), J. De La Cruz Moreno (1).
(1) Unidad de Gestión Clínica de Pediatría. Complejo Hospitalario de Jaén; (2) Hospital Costa del Sol, Marbella.
El hidrops fetal (HF) es el estadio final de numerosas enfermedades fetales que producen edema tisular y acumulación de líquido en múltiples cavidades corporales.
El síndrome de Noonan (SN) es un trastorno autosómico dominante caracterizado por talla baja, facies típica y cardiopatía congénita. Presenta gran variabilidad clínica y el fenotipo tiende a hacerse menos pronunciado con la edad. Es una causa infrecuente de HF. En el 50% de los casos es debido a mutaciones en el gen PTPN11. Otros genes implicados son SOS1, RAF1 y KRAS.
Caso clínico: RN que ingresa en UCI por hidrops fetal grave.
Antecedentes perinatales: 3ª gestación de padres aparentemente sanos no consanguíneos. Grupo sanguíneo materno A positivo con test de Coombs indirecto negativo. Ecografías 12 y 20 semanas normales. Ingreso por gestosis a las 29 semanas, en ecografía polihidramnios e hidrops fetal con derrame pleural bilateral y ascitis. Cesárea a las 30 semanas por PBF. Apgar 2-4-5.
La madre presenta un fenotipo compatible con sindrome de Noonan: Talla baja (150 cm), facies tosca, ojos prominentes con hendiduras palpebrales descendentes, orejas de implantación baja, rotadas y posteriores, cuello corto con pterigium colli y línea de implantación posterior del pelo baja.
Exploración física: Rasgos faciales no valorables por intenso edema, salvo pabellones auriculares de implantación baja. Genitales masculinos. Grupo sanguíneo: 0 positivo, Coombs directo negativo. Acidosis mixta grave y pulmón blanco bilateral, precisa intenso soporte respiratorio y hemodinámico. Fallece a las 13 horas de vida por parada cardíaca.
Exámenes complementarios: Cariotipo 46 XY. Serologías TORCH: Negativas. Necropsia: no malformaciones internas, hidrops fetal grave, enfermedad de membrana hialina y signos de asfixia perinatal. Se confirma mutación gen PTPN11 Y63C (c.188 A>G) en el exón 3 en sangre materna y tejido fetal.
Conclusiones: 1.- Destacamos la importancia de valorar el fenotipo de los padres en la evaluación de todo recién nacido con HF, que en nuestro caso condujo al diagnóstico.
2.- El diagnóstico etiológico del HF es difícil, debido a las múltiples causas que pueden producirlo, por lo que es importante el estudio exhaustivo del neonato o feto, incluyendo necropsia en caso de fallecimiento. |
| References |